- Muallif Alex Aldridge [email protected].
- Public 2023-12-17 13:52.
- Oxirgi o'zgartirilgan 2025-06-01 07:38.
Birinchi va ikkinchi tartibli reaksiyalar oʻrtasidagi asosiy farq shundaki, birinchi tartibli reaksiyalar tezligi tezlik tenglamasidagi reaktiv kontsentratsiyasining birinchi kuchiga bogʻliq, ikkinchi tartibli reaksiyalar tezligi esa konsentratsiyaning ikkinchi darajasiga bogʻliq. tarif tenglamasidagi atama.
Reaksiya tartibi - tezlik qonuni tenglamasida reaksiyaga kirishuvchi moddalar kontsentratsiyasi ko'tariladigan kuchlar yig'indisi. Ushbu ta'rifga ko'ra reaktsiyalarning bir necha shakllari mavjud; nol tartibli reaksiyalar (bu reaksiyalar reaksiyaga kirishuvchi moddalar konsentratsiyasiga bogʻliq emas), birinchi tartibli reaksiyalar va ikkinchi tartibli reaksiyalar.
Birinchi tartibli reaksiyalar nima?
Birinchi tartibli reaksiyalar kimyoviy reaksiyalar boʻlib, ularning reaksiya tezligi reaksiyada ishtirok etuvchi reaktivlardan birining molyar konsentratsiyasiga bogʻliq. Demak, reaksiya tartibi uchun yuqoridagi ta'rifga ko'ra, tezlik qonuni tenglamasida reaktiv kontsentratsiyalari ko'tariladigan kuchlar yig'indisi har doim 1 ga teng bo'ladi. Bu reaksiyalarda bitta reaktiv ishtirok etishi mumkin. Keyin bu reaktivning konsentratsiyasi reaksiya tezligini aniqlaydi. Ammo ba'zida bu reaktsiyalarda bir nechta reaktivlar ishtirok etadi, keyin bu reaktivlardan biri reaksiya tezligini aniqlaydi.
Ushbu tushunchani tushunish uchun bir misolni ko'rib chiqamiz. N2O5 parchalanish reaksiyasida NO2 va O hosil qiladi. Mahsulot sifatida 2 gazlar. U faqat bitta reaktivga ega bo'lgani uchun reaksiya va tezlik tenglamasini quyidagicha yozishimiz mumkin.
2N2O5(g) → 4NO2(g) + O 2(g)
Baho=k[N2O5(g)]m
Bu yerda k - bu reaksiya tezligi konstantasi, m esa reaksiya tartibi. Shuning uchun eksperimental aniqlashlardan m qiymati 1 ga teng. Shunday qilib, bu birinchi tartibli reaksiya.
Ikkinchi tartibli reaksiyalar nima?
Ikkinchi tartibli reaksiyalar kimyoviy reaksiyalar boʻlib, ularning reaksiya tezligi reaksiyaga kirishayotgan ikkita reaktivning molyar kontsentratsiyasiga yoki reaksiyada ishtirok etuvchi bitta reaktivning ikkinchi kuchiga bogʻliq. Shuning uchun reaksiya tartibi uchun yuqoridagi ta'rifga ko'ra, tezlik qonuni tenglamasida reaktiv kontsentratsiyalari ko'tarilgan kuchlar yig'indisi doimo 2 bo'ladi. Agar ikkita reaktiv bo'lsa, reaksiya tezligi birinchi darajaga bog'liq bo'ladi. har bir reaktivning konsentratsiyasi.
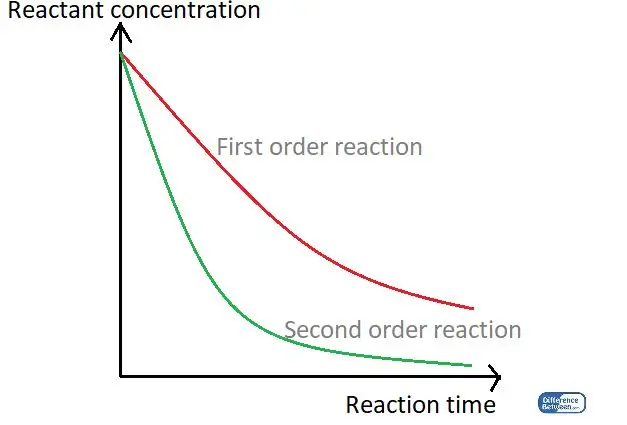
01-rasm: Reaksiya vaqti va reaktiv kontsentratsiyasidan foydalangan holda ikki turdagi reaksiya tartibini taqqoslaydigan grafik.
Agar reaksiyaga kirishuvchi moddaning konsentratsiyasini 2 marta oshirsak (tezlik tenglamasida ikkita reaktiv boʻlsa), u holda reaksiya tezligi 4 marta ortadi. Masalan, quyidagi reaktsiyani ko'rib chiqaylik.
2A → P
Bu yerda A - reaksiyaga kirishuvchi, P esa mahsulot. Agar bu ikkinchi tartibli reaksiya boʻlsa, bu reaksiya uchun tezlik tenglamasi quyidagicha boʻladi.
Baho=k[A]2
Ammo quyidagi kabi ikki xil reaktivlar bilan reaksiya uchun;
A + B → P
Baho=k[A]1[B]1
Birinchi va ikkinchi tartibli reaksiyalar oʻrtasidagi farq nima?
Birinchi tartibli reaksiyalar kimyoviy reaksiyalar boʻlib, ularning reaksiya tezligi reaksiyada ishtirok etuvchi reaktivlardan birining molyar konsentratsiyasiga bogʻliq. Demak, reaksiyaga kirishuvchi moddaning konsentratsiyasini 2 marta oshirsak, reaksiya tezligi 2 marta ortadi. Ikkinchi tartibli reaktsiyalar kimyoviy reaktsiyalar bo'lib, ularning reaktsiya tezligi reaksiyaga kirishayotgan ikkita reaktivning molyar kontsentratsiyasiga yoki reaktsiyada ishtirok etuvchi bitta reaktivning ikkinchi kuchiga bog'liq. Demak, reaktivning konsentratsiyasini 2 marta oshirsak, reaksiya tezligi 4 marta ortadi. Quyidagi infografikada birinchi va ikkinchi darajali reaksiyalar orasidagi farq jadval ko‘rinishida keltirilgan.

Xulosa - Birinchi va ikkinchi tartibli reaksiyalar
Reaksiyaning borish tartibiga ko’ra uchta asosiy reaksiya turi mavjud; nol tartibli, birinchi tartibli va ikkinchi tartibli reaksiyalar. Birinchi va ikkinchi tartibli reaktsiyalar o'rtasidagi asosiy farq shundaki, birinchi tartibli reaktsiya tezligi tezlik tenglamasidagi reaktiv kontsentratsiyasining birinchi kuchiga bog'liq, ikkinchi tartibli reaktsiya tezligi esa kontsentratsiya davrining ikkinchi darajasiga bog'liq. stavka tenglamasi.






